مقدمه
تیتر کردن از روشهای تجزیه حجمی است. در تجزیه حجمی ابتدا جسم را حل کرده و حجم معینی از محلول آن را با محلول دیگری که غلظت آن مشخص است که همان محلول استاندارد نامیده میشود، میسنجند. در تیتراسیون محلول استاندارد بهطور آهسته از یک بورت به محلول حاوی حجم مشخص یا وزن مشخص از ماده حل شده اضافه میشود .
افزایش محلول استاندارد، آنقدر ادامه مییابد تا مقدار آن از نظر اکیوالان برابر مقدار جسم حل شده شود. نقطه اکیوالان نقطه ای است که در آن، مقدار محلول استاندارد افزوده شده از نظر شیمیایی برابر با مقدار حجم مورد نظر در محلول مجهول است. این نقطه را نقطه پایان عمل از نظر تئوری یا نقطه هم ارزی نیز میگویند .
روش تیتر کردن
در عمل تیتر کردن ، محلول استاندارد را از یک بورت به محلولی که باید غلظت آن اندازه گرفته میشود، میافزایند و این عمل تا وقتی ادامه دارد تا واکنش شیمیایی بین محلول استاندارد و تیتر شونده کامل شود. سپس با استفاده از حجم و غلظت محلول استاندارد و حجم محلول تیتر شونده، غلظت محلول تیتر شونده را حساب میکنند .
مثال:
نقطه اکیوالان در عمل تیتر کردن NaCl با تیترات نقره وقتی مشخص میشود که برای هر وزن فرمولی Cl- در محیط یک وزن فرمول Ag+ وارد محیط عمل شده باشد و یا در تیتر کردن، اسید سولفوریک اسید (H2SO4)با هیدروکسید سدیم (NaOH)نقطه اکیوالان وقتی پدید میآید که دو وزن فرمولی اسید و دو وزن فرمولی باز وارد محیط عمل شوند .
تشخیص نقطه اکیوالان در عمل بوسیله تغییر فیزیکی ( مثلا تغییر رنگ ) شناخته میشود. نقطهای که این تغییر رنگ در آن روی میدهد، نقطه پایان تیتر کردن است. در تیتراسیون اسید و باز شناساگرها برای تعیین زمان حصول نقطه اکیوالان بکار میروند. تغییر رنگ معرف ، نشانگر نقطه پایانی تیتراسیون میباشد.
انواع تیتر کردن
بر حسب واکنشهایی که بین محلول تیتر شونده و استاندارد صورت میگیرد، تجزیههای حجمی (تیتراسیون) به دو دسته تقسیم میشوند :
• روشهایی که بر اساس ترکیب یونها هستند. یعنی تغییر ظرفیت در فعل و انفعالات مربوط به آن صورت نمیگیرد.
این روشها عبارت اند از:
1- واکنشهای خنثی شدن یا واکنشهای اسید و باز
2- واکنشهای رسوبی
3- واکنشهایی که تولید ترکیبات کمپلکس میکنند.
• روشهایی که بر اساس انتقال الکترون هستند؛ مانند واکنشهای اکسایش و کاهش
تیتر کردن واکنش های اسید و باز یا خنثی شدن
تیتر کردن ، عبارت است از تعیین مقدار اسید یا باز موجود در یک محلول که با افزایش تدریجی یک باز به غلظت مشخص یا بر عکس انجام میگیرد. موقعی که محلول یک باز دارای یونهای OH-است به محلول اسید اضافه کنیم، واکنش خنثی شدن انجام میشود :
OH- + H3O+ —–> 2H2O
دسته بندی واكنشهای تیتراسیون
الف)تیتراسیون های اسید باز شامل :
اسید و باز قوی
اسید ضعیف با باز قوی
باز ضعیف با اسید قوی
اسید و باز ضعیف
ب) تیتراسیون های رسوبی شامل :
تیتراسیون با تیترانت های غیر آلی
تیتراسیون های سورفكتنتها
تیتراسیونهای اكسیداسیون و احیا ( ردكس )
تیتراسیون های كمپلكسومتری / كیلیتومتری
کاربردهای نوعی تیتراسیونهای خنثیشدن
تیتراسیونهای خنثیشدن در اندازهگیری آن دسته از گونههای بیشمار معدنی، آلی و زیستی که خواص اسیدی یا بازی ذاتی دارند بکار برده میشوند. ولی کاربردهای بسیاری به همان اندازه اهمیت وجود دارند که در آنها ترکیب مورد تجزیه با یک واکنشگر مناسب به یک اسید یا باز تبدیل و سپس با یک باز یا اسید قوی استاندارد تیتر میشود .دو نوع عمده از نقاط پایانی بطور گسترده در تیتراسیونهای خنثیشدن بکار برده میشود.
نوع اول یک نقطه پایانی بصری است و بر پایه تغییر رنگ شناساگر قرار دارد. نوع دوم یک نقطه پایانی پتانسیومتری است که در آن پتانسیل یک سیستم الکترود شیشه _ کامومل با یک وسیله اندازه گیری ولتاژ تعیین میشود . پتانسیل اندازه گیری شده مستقیما متناسب با PH است .
تجزیه عنصری
تعدادی از عناصر مهم را که در سیستمهای آلی و زیستی دخالت میکنند، میتوان به سهولت با روشهایی که در مرحله پایانی به یک تیتراسیون اسید و باز ختم میشوند، اندازه گیری کرد. عموما عناصری که قابلیت این نوع تجزیه را دارند، غیر فلزند و شامل کربن ، نیتروژن ، گوگرد ، کلر ، برم ، فلوئور و چند گونه نامتداول دیگرند. در هر مورد ، عنصر به یک اسید یا باز معدنی تبدیل و متعاقبا تیتر می شود . بعنوان مثال ، نیتروژن در بسیاری از مواد با اهمیت در پژوهش ، صنعت ، کشاورزی یافت میشود. مثلا نیتروژن در اسیدهای آمینه ، پروتئینها ، داروهای سنتزی ، کودهای شیمیایی ، مواد منفجره ، خاک ، آبهای آشامیدنی و رنگها وجود دارد. پس روشهای تجزیهای برای تعیین نیتروژن بویژه در مواد آلی از اهمیت بسیاری برخوردارند .
اندازه گیری مواد معدنی
تعداد زیادی از گونههای معدنی را میتوان توسط تیتراسیون با اسیدها یا بازهای قوی اندازه گیری کرد. بعنوان مثال ، نمکهای آمونیوم را میتوان بسادگی با تبدیل به آمونیاک توسط باز قوی و سپس تقطیر در دستگاه کلدال اندازه گیری کرد. آمونیاک طبق روش کلدال جمع آوری و تیتر میشود. روشی را که برای نمکهای آمونیوم بیان شد، میتوان برای اندازه گیری نیترات و نیتریت معدنی تعمیم داد .تعیین گروههای عاملی آلی تیتراسیونهای خنثیشدن برای سنجش مستقیم و غیر مستقیم انواع گروههای عاملی آلی روشهای سادهای را فراهم میکنند .
روش کار و محاسبات
معمولا حجم مشخص (V) از محلول اسید با نرمالیته مجهول (N) انتخاب کرده ، بهکمک یک بورت مدرج بهتدریج محلو ل یک باز به نرمالیته مشخص (N) به آن اضافه میکنند. عمل خنثی شدن وقتی کامل است که مقدار اکیوالان گرمهای باز مصرفی برابر مقدار اکیوالان گرم های اسید موجود در محلول شود .
برای این که عمل تیتراسیون به دقت انجام شود، باید عمل افزایش محلول باز درست موقعی متوقف گردد که تساوی فوق برقرار شود. روش معمول و همگانی برای تعیین پایان تیتراسیون استفاده از شناساگرهاست. دستگاه PH متر نیز برای محاسبات دقیق در تعیین نقطه اکی والان کاربرد دارد .
آزمایش تیتر کردن اسید و باز
تئوری آزمایش
در روش تیتر کردن سلولی با غلظت مشخصی به محلول دیگر اضافه میشود تا واکنش شیمیایی بین دو ماده حل شده کامل گردد. محلولی که غلظت آن مشخص باشد، محلول استاندارد است. در عمل تیتر کردن، محلول استاندارد را از یک بورت به محلولی که باید غلظت آن اندازه گرفته شود، میافزایند و این عمل تا وقتی ادامه دارد که واکنش بین محلول استاندار تیتر شونده کامل شود.
پس با استفاده از حجم و غلظت محلول استاندارد و حجم محلول تیتر شونده ، غلظت محلول تیتر شونده را حساب میکنند.
الف)وسایل لازم:
1)بورت 50 میلی لیتر
2)بالون ژوژه 100 میلی لیتری و 50 میلی لیتری
3)ارلن مایر 250 میلی لیتری
4)بشر 100 میلی لیتری
5)ترازوی دقیق
ب)مواد شیمیایی لازم:
1)تیتر ازول کلریدریک اسید 0،1 نرمال
2)سود
3)اگزالیک اسید خالص
4)فنل فتالئین
روش آزمایش
بخش اول : تعیین نرمالیته سود مجهول
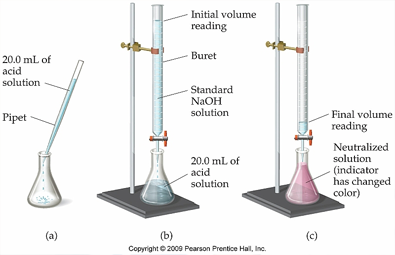
نمونه مجهول سود (NaOH) در بالون ژوژه 100 میلی لیتری را با آب مقطر به حجم رسانده، هم میزنیم. پس یک بورت
25 میلی لیتری را ابتدا با آب مقطر سپس با محلول سود تهیه شده شستشو میدهیم و توسط گیره به پایه متصل میکنیم.
داخل بورت، محلول سود ریخته و محلول را در صفر تنظیم میکنیم . در نوک بورت نباید حباب هوا وجود داشته باشد. در صورت وجود داشتن هوا در نوک بورت باید شیر بورت را کمی باز کرد تا نوک بورت از مایع پر شود. در موقع خواندن بورت، چشم باید در امتداد سطح مایع بوده و عدد مقابل خط زیر سطح مقعر مایع خوانده شود . حال یک ارلن مایر که پیپت10میلی لیتری و با اسیدکلریدریک 0،1 نرمال شستشو دادهایم.10 میلی لیتر اسید کلریدریک 0،1 نرمال میریزیم. سپس 2 قطره فنل فتالئین اضافه میکنیم. ارلن را زیر بورت قرار داده ، با دست چپ بشر بورت را باز میکنیم تا قطره قطره محلول سود به محلول اسید اضافه شود و با دست راست، ارلن را بهآهستگی حرکت دورانی میدهیم. طی این عمل، محلول داخل ارلن، رنگ ارغوانی (صورتی رنگ) میشود و این نشانگر بازی شدن محلول داخل ارلن است. افزایش سود را متوقف کرده و حجم سود مصرفی را از روی بورت میخوانیم .
از فرمول زیر نرمالیته سود مجهول بهراحتی محاسبه میشود:
اسید V * اسید N = سود V * سود N
اسید V * اسید N /سود N = سود N
بخش دوم : تعیین نرمالیته اگزالیک اسید
یک گرم اسید اگزالیک را داخل بشر 100 میلی لیتری ریخته و کمی آب مقطر به آن اضافه میکنیم تا حل شود و سپس محلول را به یک بالون ژوژه 50 میلی لیتری انتقال داده و به حجم میرسانیم. توسط پیپت ژوژه، 10 میلی لیتر از این محلول را داخل ارلن مایر 250 میلی لیتری میریزیم و دو قطره فنل فتالئین به آن اضافه میکنیم. سپس بورت را از سود با نرمالیته معلوم پر میکنیم و محلول داخل ارلن را با آن تیتر میکنیم .
روش تیتر کردن به این صورت است که طبق بخش اول، سود را قطره قطره به محلول داخل ارلن افزوده تا صورتی کمرنگ ایجاد شود. سپس حجم بورت را یادداشت میکنیم. نرمالیته اسید با استفاده از رابطه زیر بهسادگی حاصل میشود.
سود V *سودN = اسید V * اسید N
سود V *سود N / اسید N = اسید N
نتایج آزمایش
با استفاده از رابطه فوق با داشتن حجم اسید، حجم و نرمالیته باز میتوان نرمالیته اسید را بدست آورد.
با معلوم بودن حجم باز و نرمالیته و حجم اسید بهراحتی میتوان نرمالیته باز را محاسبه کرد.
رابطه فوق را برای حجم هر واحدی میتوان استفاده کرد، مشروط بر اینکه هر دو حجم (یعنی اسید V و باز V ) دارای یک واحد باشند.
محلولی که دارای نرمالیته یکسان باشد، با حجمهای مساوی بر یکدیگر اثر میکنند . روشی که توسط آن ، محلولی با غلظت مشخص به محلولی دیگر اضافه میشود تا واکنش شیمیایی بین دو ماده حل شده کامل گردد، تیتراسیون نامیده میشود




























